심질환 환자에서 오메가-3 지방산, 비타민, 킬레이션 요법의 효과
Effects of omega-3 fatty acids, vitamins, and chelation therapy in patients with heart diseases
Article information
Trans Abstract
Omega-3 fatty acids (eicosapentaenoic acid [EPA] and docosahexaenoic acid [DHA]) may be beneficial for the primary and secondary prevention of cardiovascular events (CVEs), especially in patients with myocardial infarction or heart failure with reduced ejection fraction. For this purpose, one to two seafood meals per week is preferentially recommended. Omega-3 fatty acids with a high-dose EPA formula (4 g/day) may be more effective than EPA+DHA mixed supplements for the secondary prevention of CVE. Krill oil also contains omega-3 fatty acids, but at a much lower dose compared to fish oil. Supplemental vitamins and minerals have not shown the preventive effects on CVE in prospective, and randomized clinical trials, except for one Chinese study showing the stroke prevention effects of folic acid. The clinical benefit of chelation therapy in reducing CVEs is uncertain.
서론
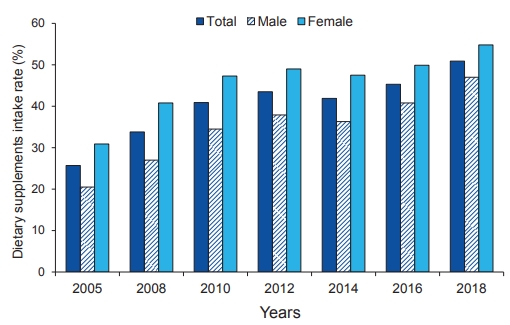
건강에 대한 관심이 높아지면서 식이 보충제(dietary supplement)를 복용하는 우리나라 국민의 비율이 점차 증가하고 있다. 2020년 발표된 국민건강통계에 의하면 최근 1년 내에 종합비타민, 비타민 A, 비타민 C, 비타민 D, 칼슘, 무기질, 철분, 오메가-3 지방산 등의 식이 보충제를 복용 경험이 있다고 응답한 사람은 2005년 26%에서 2018년 50%로 2배 증가하였다(Fig. 1) [1]. 하지만 식이 보충제의 임상적 효능은 확실치 않다. 관찰 연구에서는 비타민, 오메가-3 지방산 등을 복용하는 사람에서 심혈관계 합병증 발생이 적게 관찰된다는 보고가 있으나 교육 수준과 사회경제 수준이 높고 흡연율과 고위험 음주율이 낮고 비만하지 않으며 운동을 자주하고 건강한 식사습관을 갖고 있어서 심혈관계 합병증 발생이 낮을 것으로 예상되는 사람이 오히려 식이 보충제를 더 많이 복용하기 때문에 마치 좋은 효과가 있는 것처럼 보인다는 의견이 지배적이다[2]. 국내 연구에서도 여성, 중년, 고학력, 흡연율과 음주율이 낮은 성인에서 식이 보충제를 많이 복용한다고 보고되었다[3]. 사실 무작위 대조 전향적 임상 시험에서는 식이 보충제의 임상 효과가 거의 증명 되지 않았다.
이 종설에서는 오메가-3산과 비타민 등의 심혈관계 효과에 대해서 무작위 대조 임상 시험과 전향적 코호트 연구를 중심으로 고찰하고자 한다. 또한 일명 “혈관 청소”라고 불리는 킬레이션 요법(chelation therapy)의 효능도 검토하려고 한다.
본론
1. 오메가-3 지방산
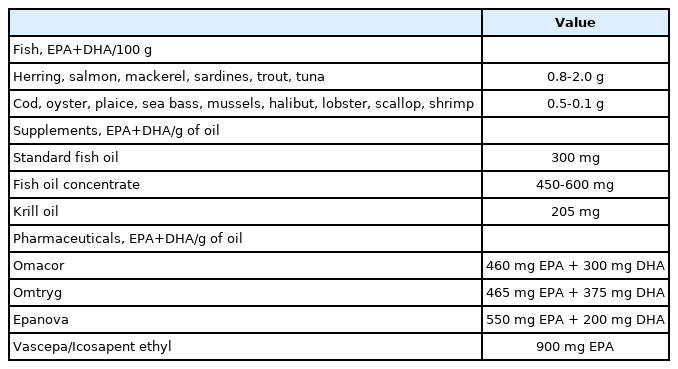
오메가-3 지방산은 필수 불포화지방산(polyunsaturated fatty acid)의 일종으로 메틸산 끝 부분(오메가 혹은 n)에서부터 3번째 탄소 원자에서 첫 번째 이중 결합이 시작되어 오메가-3 혹은 n-3 지방산으로 불린다. 기능적 중요성이 있는 오메가-3 지방산에는 eicosapentaenoic acid (EPA; 20:5n-3)와 docosahexaenoic acid (DHA; 22:6n-3)가 있다(Fig. 2). 고등어, 청어, 정어리, 대구, 가자미, 참치, 조개, 굴, 바다가재 등의 어류가 오메가-3 지방산의 주된 공급원이다(Table 1). 호두, 땅콩, 피칸 등의 견과류에 있는 alpha-linolenic acid를 섭취하면 체내에서 일부 EPA와 DHA로 변환되기는 하나 그 양이 많지 않기 때문에 건강 상태를 유지하기 위해서 EPA와 DHA를 직접 섭취해야 한다[4,5].
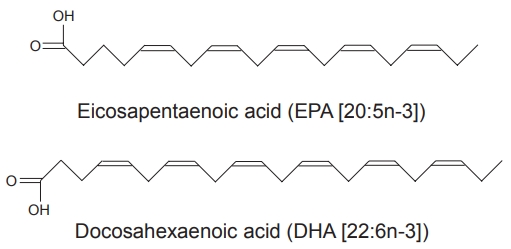
Structure of omega-3 polyunsaturated fatty acids. Eicosapentaenoic acid (EPA; 20:5n-3) is a carboxyl acid (enoic acid) that comprises 20 (eicosa) carbons and 5 (penta) double bonds, of which the closest double bond to the metyl end (n) of the hydrocarbon chain is at carbon number 3. Docosahexaenoic acid (DHA; 22:6n-3) is a carboxyl acid that comprises 22 (docosa) carbons and 6 (hexa) double bonds, of which the closest double bond to the metyl end (n) of the hydrocarbon chain is at carbon number 3.
어류를 많이 섭취하는 그린랜드 에스키모인의 심혈관질환 발생률이 낮다는 역학결과에 기초하여 시행된 관찰적 임상 연구에서는 오메가-3 지방산을 많이 섭취할수록 관상동맥질환과 뇌졸중의 발생률, 사망률 등이 낮아진다는 결과들이 있으나 무작위 대조 임상 시험에서는 그렇지 않다는 결과들이 보고되었다[4,5].
1) 오메가-3 지방산의 심혈관계 작용 기전
오메가-3 지방산은 혈중 지질치에 영향을 미치는데 중성지방의 주된 구성 성분인 초저밀도 지단백이 간에서 합성되는 것을 감소시켜서 혈중 중성지방치를 낮춘다. 오메가-3 지방산의 복용량이 하루 6 g이 될 때까지 용량에 비례하여 혈중 중성지방치가 감소한다. 특히 혈중 중성지방치가 높은 사람이 복용하였을 때 그 효과는 더 커서 오메가-3 지방산을 하루 1 g 복용할 때마다 혈중 중성지방치는 평균 8.4 mg/dL 감소한다[4]. 고밀도(high density lipoprotein, HDL) 콜레스테롤치와 저밀도(low density lipoprotein, LDL) 콜레스테롤치는 상승시킨다[5].
항염증 효과도 갖고 있는데 아라키돈산(arachidonic acis) 대사생성물의 염증 효과를 차단하며 혈중 C-반응단백과 염증 사이토카인(cytokine)인 tumor necrosis factor-α, interleukin (IL)-1β, IL-6 등의 수치를 낮춘다[5,6].
혈관계에 대한 영향으로 심장 자극전도계에 작용하여 안정시 심박수를 감소시키고 심박수 변이성(heart rate variability)을 증가시키며, 일산화질소(NO) 생성 증가, 혈관 내피세포 확장능과 동맥 탄성도(compliance) 증가 등의 기전을 통하여 수축기 및 이완기 혈압을 감소시킨다[5,6]. 그러나 이러한 효과보다 오메가-3 지방산이 심혈관계 사망을 감소시키는 주된 기전으로 제시되는 것은 항부정맥 효과이다. 동물 실험 혹은 in vitro 연구에서 오메가-3 지방산은 소듐, 칼슘 세포막 이온 통로나 세포 간 connexins에 작용하여 심방과 심실 심근세포의 전기생리학적 기능에 영향을 미친다. 사람에서는 항부정맥 효과를 측정할 수 있는 믿을만한 전기생리적 방법이나 생화학적 지표나 없어서 직접적으로 증명하기는 힘들지만 임상 연구에서 오메가-3 지방산이 심장 돌연사의 위험을 감소시키는 것으로 보고되어 항부정맥 효과를 간접적으로 입증하고 있다[4]. 또한 혈소판응집과 혈관수축 작용이 있는 트롬복산(thromboxane) A2의 생성을 감소시켜서 항혈전 효과를 갖고 있다[5,6].
2) 오메가-3 지방산의 일차 예방 효과
2007년에 발표된 The Japan EPA Lipid Intervention Study (JELIS)는 일본 성인 18,645명을 대상으로 1.8 g/day EPA+스타틴 혹은 스타틴만 투약한 후 5년간 추적 관찰하였다. 이 중 14,981명의 심혈관질환의 병력이 없는 성인을 대상으로 분석한 주 심혈관사건(급사, 치명적 혹은 비치명적 심근경색증, 불안정형 협심증, 관동맥우회술, 경피적 관동맥시술 등)의 발생은 EPA+스타틴 투약군에서 18% 감소하였지만 두 군 사이에 유의한 차이가 없어서 EPA의 일차 예방 효과는 증명되지 않았다[7].
최근 오메가-3 지방산의 일차 예방 효과에 대한 2개의 대규모 임상 연구가 발표되었다. The A Study of Cardiovascular Events iN Diabetes (ASCEND) 연구는 심혈관질환이 없는 15,480명의 당뇨병 환자를 대상으로 840 mg/day EPA+DHA 혹은 올리브 오일을 투약한 후 7.4년간 추적 관찰하였는데, 주 혈관사건(심근경색증, 뇌졸중, 혈관질환 사망 등) 발생에는 차이가 없었지만 혈관질환 사망은 오메가-3 지방산 투약군에서 약 20% 감소하였다(rate ratio [RR], 0.81; 95% confidence interval [CI], 0.67-0.99) [8]. The Vitamin D and Omega-3 Trial (VITAL) 연구는 50세 이상의 건강한 남성 혹은 55세 이상의 건강한 여성 25,871명을 대상으로 오메가-3 지방산(840 mg/day EPA+DHA)을 평균 5.3년간 무작위 투약하였는데 주 심혈관사건(심근경색증, 뇌졸중, 심혈관 사망 등)의 발생에는 차이가 없었다. 그런데 오메가-3 투약군에서 심근경색증(hazard ratio [HR], 0.72; 95% CI, 0.59-0.90)과 관동맥심질환(HR, 0.83; 95% CI, 0.71-0.97)이 적게 발생하였다[9].
결론적으로 최근 발표된 ASCEND 연구와 VITAL 연구를 종합하면 비록 일차 연구 종말점은 감소시키진 못하였으나 이차 개별 종말점에서 일부 임상 효능이 있었기 때문에 심근경색증 발생과 심장혈관 사망 대한 오메가-3 지방산의 일차 예방 효과가 어느 정도 있을 것으로 추정된다.
3) 오메가-3 지방산의 이차 예방 효과
2010년 이전에 시행된 무작위 대조 임상 시험에서는 오메가-3 지방산의 심혈관사건 이차 예방 효과가 있다고 보고되었다. 심근경색증 환자에서 오메가-3 지방산 섭취 효과를 관찰한 첫 무작위 전향적 연구는 Diet and Reinfarction Trial이었다[10]. 2,033명의 남자 심근경색증 환자를 대상으로 하였는데 1주 2회 이상 오메가-3 지방산이 풍부한 생선을 섭취하도록 교육한 환자군에서 총 사망률이 29% 감소하였다. 이 연구결과를 바탕으로 이탈리아에서 3개월 이내에 심근경색증이 발생한 11,324명의 남자 환자를 대상으로 하는 The Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico (GISSI)-Preventione 연구가 진행되었다[11]. 치료군에서 840 mg/day EPA+DHA가 함유된 연질 갭슐을 평균 3.5년간 복용하였다. 그 결과 치료군의 총 사망률과 심혈관계 사망률이 각각 20%, 30% 감소하였으며 특히 심장 돌연사는 45% 감소하였다. 이러한 사망률 감소 효과는 투약 초기부터 관찰 되었는데 치료 3개월 후 전체 사망률이 감소하기 시작하였고 심장 돌연사는 투약 4개월 후부터 감소하여 오메가-3 지방산의 심혈관계 사망률 감소는 주로 항부정맥 효과에 의한 심장 돌연사의 예방 효과로 추정되었다[12]. GISSI-heart failure 연구에서는 6,975명의 만성 심부전 환자에게 840 mg/day EPA+DHA를 무작위 투약하고 평균 3.9년 관찰하였는데 총 사망률은 8%, 총 사망률과 재입원율은 9% 유의하게 감소하였다[13]. JELIS 연구에서 관동맥질환의 과거력이 있는 환자 3,644명을 대상으로 EPA의 이차 예방 효과를 분석하였는데 심혈관 사망을 감소시키지는 못하였지만 주요 관동맥사건을 19% 유의하게 감소시켰다[7].
그러나 2010년대 초반에 발표된 무작위 전향적 임상 연구에서는 오메가-3 지방산의 이차 예방 효과가 증명되지 못하였다. Alpha-Omega 연구에서는 4,837명의 심근경색증 환자를 대상으로 오메가-3 지방산이 함유된 마가린을 섭취시켜서 하루 EPA+DHA 400 mg을 4년간 보충하도록 하였다. 실제로 복용한 EPA+DHA 양은 376 mg/day였다[14]. 그러나 EPA+DHA 섭취군에서 심혈관계 사건이나 사망률이 감소하지 않았다. 사후 당뇨병 환자를 대상으로 하는 분석에서만 관동맥질환에 의한 사망률이 49% 감소하는 효과를 관찰할 수 있었다. OMEGA 연구에서는 심근경색증 발병 2주 이내의 환자 3,851명에게 840 mg/day EPA+DHA를 무작위 배정 한 후 1년간 추적 관찰하였는데 오메가-3 지방산 투약군에서 심장 돌연사 혹은 심혈관계 사건 발생이 감소하지 않았다[15]. The Supplémentation en Folates et Omega-3 (SU.FOL.OM3) 연구에서는 심근경색증, 불안정형 협심증, 혹은 허혈성 뇌졸중의 과거력이 있는 2,501명을 대상으로 EPA+DHA 600 mg/day를 무작위 배정 투약하고 평균 4.7년 관찰하였는데 투약군과 대조군 사이에 심혈관계 사건 발생률의 차이가 없었다[16]. 심혈관사건 발생의 고위험군을 대상으로 한 The Outcome Reduction with an Initial Glargine Intervention 연구와 The Risk and Prevention Study에서도 오메가-3 지방산의 이차 예방 효과가 없었다[17,18].
하지만 2010년대 초반에 발표된 임상 연구의 가장 큰 문제점으로 지적되는 사항은 연구 설계시 예상하였던 심혈관계 사망률보다 실제 연구 종료 시점에서 발생한 심혈관계 사망률이 낮아서 충분한 통계적 검증력을 갖고 있지 못하다는 것이다. GISSI-Preventione 연구가 시작된 1990년대에는 심근경색증 환자에게 스타틴이 보편적으로 처방되지 않던 시기여서 연구 종료 시점에 스타틴을 복용 중인 환자는 46%에 불과하였다. 반면에 Alpha-Omega와 SU.FOL.OM3 연구에서는 연구 대상의 85%가 스타틴을 복용하고 있었으며 OMEGA 연구에서는 94%의 환자가 복용하였다. 그리고 최근 연구에 포함된 심근경색증 환자에서는 초기 재관류 요법이 더 보편적으로 사용되었고 거의 모든 환자에서 항혈소판제가 투약되어 심혈관계 사건이 예상보다 적게 발생하였다. 또한 이미 환자들이 오메가-3 지방산 섭취가 심혈관계 사망을 감소시킨다는 것을 알고 있기 때문에 대조군에 배정된 환자들도 생선 섭취를 많이 하고 육류 섭취는 줄이는 식습관을 갖고 있는 상황에서 오메가-3 지방산의 효과를 관찰하기 위한 무작위 배정 연구를 설계하고 그 효과를 입증하는 것이 점점 힘들게 되었다[4].
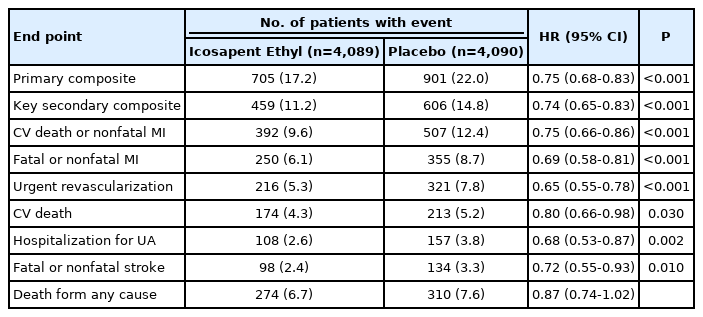
그러나 2019년 발표된 The Reduction of Cardiovascular Events with Icosapent Ethyl-Intervention Trial (REDUCE-IT) 이후 오메가-3 지방산의 효과가 재평가되기 시작하였다[19]. REDUCE-IT은 심혈관질환이 있는 45세 이상의 환자(전체 대상자 중 70.7%) 혹은 당뇨병과 1개 이상의 심혈관 위험인자가 있는 50세 이상의 환자(29.3%) 중 스타틴을 복용하여 LDL-콜레스테롤 수치가 41-100 mg/dL로 유지되고 고중성지방혈증(150-449 mg/dL)이 있는 8,179명에게 고용량의 EPA (4 g/day)를 무작위 배정하여 평균 4.9년 추적 관찰하였는데 EPA 투약군에서 일차 종말점(심혈관 사망, 심근경색증, 뇌졸중, 관동맥 혈관재형성[revascularization], 불안정형 협심증 등)은 25%, 심혈관 사망은 20% 감소하였다(Table 2). 하지만 심방세동에 의한 입원율은 EPA 투약군에서 높았다(3.1% vs. 2.1%).
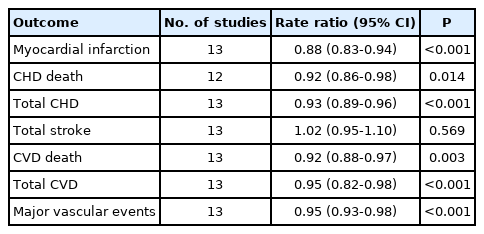
2019년까지 발표된 13개의 무작위 대조 임상 시험의 메타분석 결과가 최근 보고되었다[20]. 이 중 REDUCE-IT은 다른 임상 시험과 달리 상당한 고용량(4 g/day)의 EPA 단독제를 사용하였기 때문에 이 임상 시험을 제외하고 분석하여도 오메가-3 지방산은 심근경색증(RR, 0.92; 95% CI, 0.86-0.99), 관동맥심질환 사망(RR, 0.92; 95% CI, 0.86-0.98), 총 관동맥심질환(RR, 0.95; 95% CI, 0.91-0.99), 심혈관 사망(RR, 0.93; 95% CI, 0.88-0.99), 총 심혈관질환(RR, 0.97; 95% CI, 0.94-0.99) 등의 발생 감소와 관련이 있었다. REDUCE-IT를 포함시켜서 분석하면 심근경색증(RR, 0.88; 95% CI, 0.83-0.94)과 총 관동맥심질환(RR, 0.93; 95% CI, 0.89-0.96) 발생 감소 효과가 더 뚜렷하였다(Table 3).
4) EPA만 함유된 오메가-3 지방산과 EPA와 DHA가 복합된 오메가-3 지방산의 차이
JELIS 연구와 REDUCE-IT에서는 EPA만 함유된 오메가-3 지방산을 투약하였고 나머지 임상 연구에서는 EPA와 DHA가 복합된 오메가-3 지방산을 투약하였다. 이 중 고용량(4 g/day)의 Icosapent Ethyl을 사용한 REDUCE-IT의 임상결과가 가장 좋게 나왔다. 최근 REDUCE-IT와 유사한 고중성지방혈증이 있는 심혈관질환 고위험 환자를 대상으로 Epanova (550 mg EPA+200 mg DHA) 투약의 효과를 관찰한 A Long-Term Outcomes Study to Assess Statin Residual Risk Reduction With Epanova in High Cardiovascular Risk Patients With Hypertriglyceridemia는 중간분석결과 효과가 없을 것으로 판단되어 조기 중단되었고 최종결과에서 일차 종말점(심혈관 사망, 심근경색증, 뇌졸중, 관동맥 혈관재형성, 불안정형 협심증 등)의 발생은 옥수수 오일을 투약한 대조군과 차이가 없어서 실망스러운 결과를 보여주었다(HR, 0.99; 95% CI, 0.90-1.09)[21].
또한 최근 2-8주 이내에 급성 심근경색증이 있었던 70세 이상의 고령의 환자를 대상으로 1.8 g/day EPA+DHA와 옥수수 오일을 비교한 The OMega-3 fatty acids in Elderly with Myocardial Infarction 연구에서도 일차 종말점(심근경색증, 예정되지 않은 관동맥 혈관재형성, 뇌졸중, 사망, 심부전에 의한 입원 등) 발생의 차이가 없었다(HR, 1.08; 95% CI, 0.82-1.41) [22].
이러한 EPA만 함유된 오메가-3 지방산과 EPA와 DHA가 복합된 오메가-3 지방산의 임상 효과 차이를 설명하는 기전이 최근 제시되었는데 EPA에는 20개의 탄소, DHA에는 22개의 탄소가 있다는 구조적 특성 때문에 조직 분포, 세포막 구조, 지질산화속도, 염증성 반응, 내피세포기능에 미치는 영향에 차이가 있어서 EPA 단일제보다 EPA와 DHA 복합제의 효과가 좋지 않았다고 해석하였다[23]. 결론적으로 현재로선 고용량의 EPA 단일제의 심혈관사건 예방 효과가 가장 좋을 것으로 추정된다.
5) 크릴 오일(krill oil)
크릴은 많은 해양 생물의 먹이가 되는 새우처럼 생긴 작은 갑각류이다. 크릴은 오메가-3 지방산이 풍부한 조류(algae)를 섭취하므로 EPA와 DHA의 천연 자원 역할을 한다. 어유(fish oil)와 크릴 오일의 가장 큰 차이점은 오메가-3와 혼합된 지방산인데 어유의 오메가-3는 중성지방이나 에틸 에스터(ethyl ester), 크릴 오일은 인지질(phospholipid)과 각각 혼합되어 있다. 다른 차이점으로 크릴 오일에는 구운 요리가 된 연어가 붉은색을 띄게 하는 astaxanthin이 있다는 것이다. Astaxanthin은 항산화효과가 있어서 HDL-콜레스테롤 수치를 낮추긴 하지만 임상적 효과가 증명된 적은 없다. 캡슐 1개에 함유된 오메가-3 양에도 차이가 있는데 어유식이 보충제 1캡슐에 EPA+DHA가 300-600 mg 있는 반면에 크릴 오일에는 그보다 적은 200 mg 이하의 오메가-3만 함유되어 있다(Table 1) [24].
크릴 오일 복용 후 지질치 변화를 관찰한 7개의 전향적 무작위 배정 임상 시험의 메타분석에서 크릴 오일 복용 후 LDL-콜레스테롤과 중성지방은 각각 15.5 mg/dL, 14 mg/dL 낮아지고 HDL-콜레스테롤은 6.7 mg/dL 올라갔다[25]. 크릴 오일에 포함된 인지질이 오메가-3 흡수 효율성을 높였다는 일부 결과가 있기는 하나 동일 피험자를 대상으로 식이 보충제로 시판 중인 농축 중성지방 어유(EPA 650 mg+DHA 450 mg), 에틸 에스터 어유(EPA 756 mg+DHA 228 mg), 인지질 크릴 오일(EPA 150 mg+DHA 90 mg)의 교차 비교 연구를 시행한 결과 1일 1 g 복용으로 환산한 혈중 오메가-3 지방산 농도는 농축 중성지방 어유 복용시 가장 높았고 크릴 오일 복용시 가장 낮아서 농축 중성지방 어유 복용 후 오메가-3 지방산 농도 증가가 크릴 오일 복용 후 농도 변화의 4배 이상이었다[26]. 특히 크릴 오일 복용 후 오메가-3 지방산 농도가 오히려 감소한 피험자도 있었다.
아직까지 크릴 오일의 심혈관질환 예방 효과나 고중성지방혈증 치료 효과를 관찰한 임상 연구는 없다. 심혈관질환 예방을 위해서 권고되는 생선 섭취가 충분치 않은 사람이 어유는 캡슐 크기가 커서 삼키기 힘들고 비린내가 나기 때문에 복용을 꺼려할 때 캡슐 크기가 작은 크릴 오일이 대안이 될 수는 있을 것이다.
6) 진료지침에서 오메가-3 지방산의 권고 내용
미국심장협회(The American Heart Association, AHA)는 2002년 관찰 연구와 실험적 연구를 바탕으로 심혈관질환 예방을 위한 생선 섭취, 어유, 오메가-3 지방산 권고안을 발표하였고 2018년에 일부 수정 보완하였는데 울혈성 심부전, 관동맥심질환, 허혈성 뇌졸중, 심장 돌연사의 위험을 감소시키기 위해서 매주 1-2회 생선을 섭취할 것을 권고하였다[27]. 과다한 어류 섭취시 해양 상위 포식자에 축적된 수은과 환경 호르몬이 건강에 나쁜 영향을 미칠 수 있다는 우려가 제기되었다. 특히 상어, 황새치, 옥돔, 삼치, 눈다랑어, 돛새치, 오렌지 러피(roughy) 등의 생선에는 태아에게 신경독성 작용이 있고 어린애의 인지 기능을 떨어뜨리는 메틸 수은이 상당량 있기 때문에 가임기 여성이 이런 생선을 매주 5회 이상 섭취하는 것은 주의할 필요가 있다. 하지만 매주 1-2회의 생선을 섭취하는 것만으로 수은 중독이나 환경호르몬 중독의 가능성은 없다[27,28].
심혈관질환 예방을 위한 2017년 AHA의 오메가-3 지방산 식이 보충제 사용 권고안에서는 최근 발생한 심근경색증 환자의 관동맥심질환 재발과 심장 돌연사의 예방, 좌심실 수축기 기능이 감소한 심부전 환자의 사망률과 재입원율 감소를 위해서 오메가-3 지방산을 복용하는 것은 합리적인 선택(class IIa, reasonable)으로 추천되고 있다. 하지만 심혈관질환 고위험군이나 반복적 심방세동 환자에서 뇌졸중 위험을 감소시킬 목적이나 관동맥심질환, 심부전, 심방세동 등의 일차 예방 목적으로는 추천되지 않았다[29]. 그러나 이후 ASCEND 연구, VITAL 연구와 REDUCE-IT 등이 발표되었기 때문에 2017년 권고안은 추후 일부 수정될 가능성이 있다. REDUCE-IT 이후 발표된 AHA 권고안에서는 고중성지방혈증 치료를 위해서 하루 4 g의 오메가-3 지방산을 복용할 수 있다고 하였다[30].
2. 비타민과 무기질(mineral)
비타민과 무기질은 일반인이 가장 흔히 복용하는 식이 보충제로 우리나라 국민의 약 20%가 복용하고 있다고 보고되었다[3]. 역학 연구에서 비타민 결핍이 심혈관질환 발생과 관련이 있고 관찰 연구에서 비타민을 복용하는 사람에서 심혈관질환이나 심혈관사건이 적게 발생한다고 보고되었으나 전향적 무작위 배정 임상 시험에서는 비타민 복용이 심혈관질환 발생을 낮춘다는 보고는 거의 없다.
1) 멀티비타민(multivitamins)
멀티비타민은 가장 많이 복용하는 비타민 제형이다. 대규모 관찰 연구에서는 멀티비타민이 관동맥심질환 발생을 감소시킨다고 보고되었으나[31] 50세 이상의 남자 의사 14,641명을 대상으로 시행한 전향적 무작위 배정 연구인 Physicians Health Study II에서는 멀티비타민이 심근경색증, 뇌졸중, 심혈관 사망 등을 감소시키지 못하였다[32]. 10개 전향적 연구의 메타분석에서도 멀티비타민 복용이 심근경색증, 뇌졸중, 심혈관 사망, 총 사망 등을 감소시키지 못하였다[33].
2) 항산화 비타민/무기질
셀레니움(selenium), 아연(zinc), 구리(copper), 망간(manganese) 등은 산화 자유기(oxygen free radical)를 환원시키는 효소계에 필요한 무기질이다. 비타민 A, 비타민 C, 비타민 E, 베타 카로틴(beta-carotene) 등은 산화 자유기와 작용하여 LDL의 산화 손상을 차단하는 항산화제 역할을 한다. 관찰 연구에서 이러한 항산화제 복용이 심혈관 위험 감소와 연관이 있다고 보고되었으나 13,000여 명을 대상으로 비타민 E, 비타민 C, 베타카로틴, 셀레니움, 아연 복합제를 무작위 투약한 전향적 임상 시험에서 총 사망률과 허혈성 심혈관질환의 발생을 감소시키지 못하였다[34]. 20개 연구의 메타분석에서 항산화제의 심혈관질환 예방과 치료 효과가 없었으며 오히려 총 사망률이 약간 증가하는 경향(RR, 1.06; 95% CI, 1.00-1.12)을 보여 주었다[33].
약 4만 명의 건강한 여성 성인을 대상으로 시행한 The Women’s Health Study에서는 비타민 E가 심혈관 사망을 유의하게 감소시켰으나(RR, 0.76; 95% CI, 0.59-0.98) 여성만을 대상으로 했기 때문에 일반화하기에는 제한점이 있었다[35]. 비슷한 시기에 발표된 The Heart Outcomes Prevention Evaluation (HOPE)와 HOPE-TOO 연구에서는 비타민 E가 일차 종말점(심근경색증, 뇌졸중, 심혈관 사망 등)은 감소시키기 못하였고 오히려 심부전 발생 위험을 증가시켰다(RR, 1.13; 95% CI, 1.01-1.26) [36].
3) 엽산(folic acid), 비타민 B6, 비타민 B12
고호모시스테인혈증(hyperhomocysteinemia)은 심혈관질환 발생과 관련이 있다. 엽산, 비타민 B6, 비타민 B12 등은 혈중 호모시스테인치를 감소시키기 때문에 심혈관 위험을 감소시킬 수 있다고 제시되었지만 무작위 배정 전향적 연구에서는 그 효과가 확실히 증명되지 못하였다. HOPE 2 연구에서 엽산, 비타민 B6, 비타민 B12의 복합제는 심혈관 사망과 심근경색증은 감소시키지 못하였지만 뇌졸중의 발생은 약간 감소시켰다(RR, 0.75; 95% CI, 0.59-0.97). 그러나 불안정형 협심증에 의한 입원은 증가시켰다(RR, 1.24; 95% CI, 1.04-1.49) [37].
최근 발표된 The China Stroke Primary Prevention Trial (CSPPT)은 약 2만 명의 중국 고혈압 환자를 대상으로 엽산을 무작위 투약하였는데 뇌졸중의 발생이 약 20% 감소하였다(HR, 0.79; 95% CI, 0.68-0.93).38) 엽산의 심혈관계 효과를 관찰한 메타분석에서 엽산은 뇌졸중과 심혈관질환을 감소시켰다. 그러나 CSPPT가 이 메타분석에 강력한 영향을 미쳤는데 중국인의 엽산 섭취량이 적기 때문에 엽산 투약 효과가 과장되어 나타났으며 일반화가 어렵다는 반론도 만만치 않다[33].
4) 나이아신(niacin; 니코틴산, 비타민 B3)
낮은 HDL-콜레스테롤은 심혈관질환의 위험인자이다. 나이아신을 투약하면 혈중 HDL-콜레스테롤치가 올라가기 때문에 심혈관질환의 위험을 감소시킬 것으로 예상되었다. 그러나 스타틴 복용 환자에서 나이아신의 효과를 관찰한 대규모 전형적 임상 시험에서 심혈관사건은 감소하지 않고 간기능 이상, 근육통, 횡문근 융해증 등의 부작용 발생이 증가하였다[39,40]. 메타분석에서는 나이아신이 오히려 총 사망률을 증가시키는 경향을 보였다(RR, 1.10; 95% CI, 1.00-1.20) [33].
5) 비타민 D
비타민 D 합성과 관련 있는 태양 노출이 많은 국가의 심혈관질환과 암 발생률이 낮고 혈중 hydroxyvatamin D 농도가 낮으면 심혈관질환과 암 발생의 위험이 증가한다는 역학 연구와 관찰 연구를 바탕으로 비타민 D의 복용이 증가하고 있다. 그러나 전향적 임상 시험의 메타분석에서는 비타민 D 복용이 심근경색증, 뇌졸중, 심혈관 사망률, 총 사망률 등을 감소시키지 않았다[33].
The Vitamin D and Omega-3 Trial (VITAL) 연구는 50세 이상의 건강한 남성 혹은 55세 이상의 건강한 여성 25,871을 대상으로 비타민 D3 (cholecalciferol) 2,000 IU/day의 효과를 관찰한 대규모 전향적 임상 시험이었는데 일차 종말점인 심근경색증, 뇌졸중, 심혈관 사망의 주 심혈관사건을 감소시키지 못하였다(HR, 0.97; 95% CI, 0.85-1.12) [41]. 또한 이차 종말점인 심근경색증(HR, 0.96; 95% CI, 0.78-1.19), 뇌졸중(HR, 0.95; 95% CI, 0.76-1.20), 심혈관 사망(HR, 1.11; 95% CI, 0.88-1.40), 총 사망(HR, 0.99; 95% CI, 0.87-1.12)의 발생에도 차이가 없었다.
3. 킬레이션 요법
1938년부터 사용된 disodium ethylene diamine tetraacetic acid (EDTA)는 킬레이트화 과정을 거쳐서 생리 조직의 양이온성 금속(납, 카드늄 등) 이온과 결합하여 이들 금속을 소변으로 배설시키는 기능이 있다. Disodium EDTA가 칼슘 이온과 결합한다는 특성을 이용하여 고칼슘혈증과 디지털리스 중독 환자에 처음 사용되었다. 이후 죽상경화가 진행된 혈관에 칼슘이 존재하며 disodium EDTA 정맥주사 후 다양한 동맥경화성 질환에서 혈액 순환이 증가한다는 경험적 결과를 바탕으로 킬레이션 요법이 사용되고 있으나 2012년 AHA 허혈성 심질환의 진료지침에서 킬레이션 요법의 임상 효과에 대한 과학적인 근거가 없기 때문에 시행하지 말 것(class III)을 권고하였다[42]. 그럼에도 불 구하고 일부 옹호론자들은 킬레이션 요법이 동맥경화반을 퇴행시키고 협심증 환자의 증상을 완화시키며 혈관의 산화 스트레스를 감소시킨다는 단편적인 일부 연구결과를 바탕으로 여전히 환자 치료에 사용하고 있다. 납과 카드늄이 심혈관질환의 위험인자로 작용한다는 연구결과가 있고 EDTA 정맥주사 후 납과 카드늄의 뇨배설이 급격히 증가하기 때문에 킬레이션 요법이 체내에 축적된 중금속을 배설시킨다면 임상 효과가 있을 수도 있다[43].
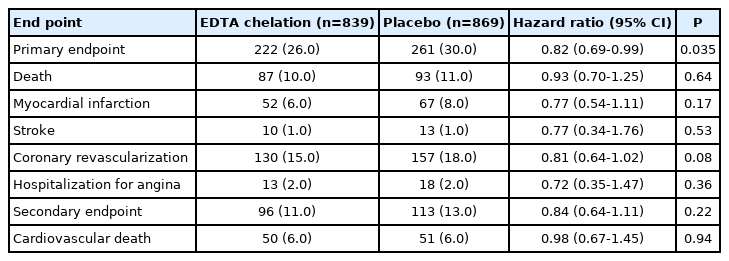
Trial to Assess Chelation Therapy (TACT)는 관동맥심질환 환자를 대상으로 킬레이션 요법의 효과를 검증하기 위해서 시행된 무작위 배정 전향적 연구였다[44]. 적어도 6주 이전에 심근경색증 과거력이 있고 혈청 크레아티닌치가 2.0 mg/dL 이하이며 50세 이상인 1,708명의 환자를 무작위 배정하여 총 40회 정맥주사하였다. 첫 30번은 매주 정맥주사하였고 이후 10번은 2-8주 간격으로 정맥주사하였다. 킬레이션 요법에 사용된 주사제는 disodium EDTA 3 g (신사구체 여과율에 따라서 감량), 비타민 C 7 g, 비타민 B1 100 mg, 비타민 B6 100 mg, magnesium chloride 2 g, procaine hydrochloride 100 mg, 헤파린 2,500 U, 칼륨 2 mEq, sodium bicarbonate 840 mg, pantothenic acid 250 mg 등을 증류수에 혼합하여 총 500 mL 용액으로 만들었다. 일차 연구 종말점은 총 사망률, 심근경색증의 재발, 뇌졸중, 관동맥 혈관재형성, 협심증에 의한 입원 등의 복합이었다. 2003년 9월에 연구가 시작되었지만 환자 모집에 어려움을 겪어서 2011년 10월까지 55개월간(중앙값) 추적 관찰되었다. 이 연구는 킬레이션 요법의 효과가 없을 것을 증명하기 위해서 미국 국립보건원의 연구비를 받아서 진행되었는데 예상과 달리 킬레이션군의 일차 종말점이 적게 발생하였다(HR, 0.82; 95% CI, 0.69-0.99). 일차 종말점 구성 요소별 분석에서 총 사망률, 심근경색증의 재발, 뇌졸중, 관동맥 혈관재형성, 협심증에 의한 입원 등에는 차이가 없었다(Table 4). 하위 분석에서는 특이 전벽부 심근경색증(HR, 0.63; 95% CI, 0.47-0.86)이나 당뇨병 환자(HR, 0.61; 95% CI, 0.45-0.83)에서 킬레이션 요법의 효과가 좋았다.
EDTA 킬레이션 요법에 대한 2상이나 3상 임상 연구가 시행된 바 없기 때문에 TACT 연구는 시작할 때부터 윤리적인 문제점을 갖고 있었음에도 불구하고 미국 국립보건원으로부터 10년간 약 3천 1백만 불의 연구비를 지원받아 진행되었다. TACT 연구 진행 과정에서 환자 모집에 어려움을 겪어서 목표 환자수를 채우지는 못하였기 때문에 연구 기간을 연장하는 방법으로 통계의 가설을 유지하도록 원안이 변경되었으며 여러 번의 중간 분석과정을 거치면서 P값이 0.036 미만인 경우 통계적인 유의성이 있는 것으로 설정되었다. 이 연구의 일차 종말점은 킬레이션군의 222명(26%), 위약군의 261명(30%)에서 발생하여 P값 0.035로 0.036 미만을 겨우 충족시켰으며 각각의 구성 요소를 개별적으로 분석하였을 때는 어느 것도 통계적 유의성에 도달하지 못하였다. 즉 킬레이션군의 일차 종말점 발생이 몇 건만 더 있었어도 이 연구결과는 통계적 의미가 없었을 것이다. 특이하게 당뇨병이나 전벽부 심근경색증이 있었던 환자에서 EDTA 킬레이션 요법이 더 효과적이었는데 그 이유는 설명할 수 없었으며 우연한 결과였을 가능성도 배제될 수 없었다.
TACT 연구에 참여한 기관의 대부분은 킬레이션 요법 이외에도 유방절제술 후 유방 재생을 위한 줄기세포 치료, 암 치료를 위한 고용량의 비타민 C 정맥주사, 당뇨병 치료에 계피(cinnamon) 사용, 소아 자폐증 치료를 위한 킬레이션 요법 등 비과학적이고 증명되지 않은 대체 요법을 시행하는 곳이기 때문에 미국 국립보건원이 이러한 곳에 거액의 연구비를 지원하였다는 것 자체가 문제점으로 제기되기도 한다. TACT 연구에서 17%의 피험자가 연구 중 동의를 철회하였는데 킬레이션군보다 오히려 위약군에서 동의 철회가 더 많았다는 것과 부작용에 의한 투약 중단이 킬레이션군 만큼 위약군에서도 많았다는 것은 이중 맹검이 지켜지지 않았거나 임상 연구의 정도 관리에 문제가 있을 가능성을 암시한다. 이러한 제한점 때문에 이 연구가 게재된 저널(JAMA) 편집진은 TACT 연구결과를 게재할 것인가에 대한 상당한 고민을 하였고 이례적으로 게재를 결정하게 된 과정과 이유를 TACT 연구 발표 동일 호에 편집자 의견으로 게재하였다. TACT 연구가 허혈성 심질환 환자에서 EDTA 킬레이션 요법이 시행될 수 있는 충분한 과학적 근거를 제시하지 못하였지만 2014년 AHA 허혈성 심질환의 진료지침 일부 개정판에서 킬레이션 요법은 추천되지 않는 치료(class III)에서 그 효과가 확실치 않은 것(class IIb)으로 권고 수준이 일부 상향 조정되었다[45]. 현재는 TACT의 결과를 재확인하기 위해서 당뇨병과 심근경색증 과거력이 있는 환자를 대상으로 한 TACT2, 당뇨병과 중증 사지 허혈이 있는 환자를 대상으로 한 TACT3a가 진행 중이며[46] 이 연구 결과들이 발표되면 킬레이션 요법에 대한 권고 수준에 변화가 있을 것으로 예상된다.
결론
오메가-3 지방산의 심혈관 합병증에 대한 일차 예방 효과와 이차 예방 효과가 어느 정도 있는 것으로 추정된다. 특히 심근경색증, 좌심실 수축기 기능이 감소된 심부전 환자에서 가장 도움이 된다. 오메가-3 지방산의 보충을 위해서 주 1-2회 생선 섭취가 우선적으로 권고된다. 오메가-3 지방산의 이차 예방 효과는 EPA와 DHA 복합제보다는 고용량의 EPA 단일제 복용시 가장 효과가 좋았다. 크릴 오일에 오메가-3 지방산이 있기는 하지만 어유 오메가-3 지방산 보다 함량이 적다. 비타민과 무기질 복용에 대한 대부분의 전향적 임상 연구에서 심혈관 합병증 예방 효과가 증명되지 않았다. 중국인을 대상으로 시행한 임상 시험에서 엽산을 복용하면 뇌졸중 발생이 감소하였지만 일반화하기 위해서는 추가 검증이 필요하다. 킬레이션 요법의 심혈관질환 감소 효과는 확실치 않고 현재 진행 중인 임상 시험결과를 지켜봐야 한다.